搜索

蛋白质笼(protein cage)是由蛋白分子以精确几何周期性排列而成的多面体笼状纳米实体,因其类病毒衣壳的精准结构与功能特性,在生物医药领域、特别是在基因递送和仿生病毒方面具有广阔的应用前景,近年来得到学界深入关注。目前构筑蛋白质笼的策略主要分为两类,一类是利用天然病毒或颗粒蛋白(如ferritin)的重组或后修饰,这种方法往往涉及繁冗的蛋白质工程化步骤;另一类是启动从头设计策略(de novo protein design),但必需艰深的蛋白界面对称设计与计算机辅助技术。且上述方法多采用构象保守的蛋白,难以实现蛋白笼的动态调控。
发展简洁通用、精准构建蛋白笼的新策略,在避免复杂生物工程与计算建模的前提下实现蛋白笼动态自适应与智能响应化组装将为生物医学与纳米仿生领域开辟一条全新道路。闫强课题组提出利用蛋白变构现象(allosterism)来操纵蛋白笼动态组装的新方法学,该方法依托变构蛋白与分子配体结合时所引发的蛋白质构象精确、大范围转变(变构现象)为推动力,驱动蛋白之间自组装形成具有多面体几何的笼状结构,并通过变构因子对蛋白构象的开闭作用调控蛋白笼的动态组装与解离。
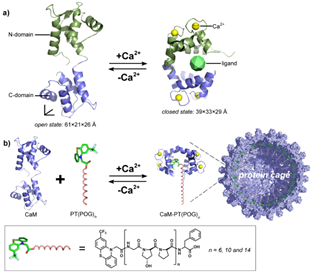
图1. (a) 钙调蛋白CaM在变构因子Ca2+调节下的变构现象;(b) 变构效应驱动的蛋白笼精确组装。
闫强课题组利用一种常见的变构蛋白——钙调蛋白(calmodulin, CaM)来实现蛋白质笼的动态调控。天然钙调蛋白在变构因子Ca2+作用下存在两种变构形式:在Ca2+环境中,钙调蛋白可与吩噻嗪类配体结合,导致N/C双端结构域折叠,使蛋白处于收缩态;而在去除Ca2+后,蛋白构象松弛,恢复解折叠的舒张态(图1a)。基于这一变构效应,设计类胶原寡肽偶联的吩噻嗪功能配体PT(POG)n,调控CaM蛋白-蛋白二聚作用、蛋白-配体识别作用与类胶原肽三重螺旋化之间的超分子协同,可实现蛋白笼的精确装配(图1b)。进而调节Ca2+水平,操纵蛋白构象转变,可以控制蛋白笼的动态组装与解组装,实现蛋白笼内核酸分子的靶向释放,模拟天然病毒信号控制的转染过程。

图2. 蛋白笼纳米尺度与配体长度关系
研究发现蛋白笼的纳米尺寸依赖于分子配体长度(图2)。随着寡肽链聚合度(n)的增加,蛋白笼的尺寸也相应扩大,分别达到19.2 nm (n = 6) ,29.4 nm (n = 10) 和40.5 nm (n = 14);同一配体形成的蛋白笼具有几何一致性。这些结果表明仅通过定制配体化学即可精确调控蛋白笼的组装结构,相比于传统策略中对蛋白本身的界面修饰或工程化,大大提高了人为改造蛋白笼结构与功能复杂性的可能。冷冻电镜和三维解析提供了蛋白笼的分子层次结构:蛋白笼具有二十面体对称性,外壳由CaM组成,内层由刚性配体PT(POG)n支撑(图3a-c),类似病毒衣壳;蛋白笼表层由正六边形周期性排列的蛋白六邻体(hexon)组装形成,每个六邻体单元又由CaM三聚产生(图3d),相邻两个单元依托CaM变构后的蛋白-蛋白相互作用形成具有确定二面角的X形互锁二聚体(图3e);而CaM三聚体则是通过配体三重螺旋化和配体-蛋白相互作用构成的三脚架形蛋白结构(图3f-g)。这三种超分子力相互协同导致蛋白笼的精确组装,其中配体分子的长度与刚性决定了笼体的几何尺寸(图3h)。相应调节Ca2+浓度控制CaM构象状态可快速解离或重组蛋白笼结构,实现内部DNA功能客体的释放。

图3. 蛋白笼的分子层次组装结构与机理
综上所述,该项研究工作提出了一种全新的动态可调的蛋白质纳米笼的组装策略,同时揭示了利用蛋白变构效应构建动态蛋白质结构材料的可能性。
以上成果以Communication的形式发表于CCS Chemistry上。Xu, M.; Zeng R.; Yan Q.* Self-Assembly of Switchable Protein Nanocages via Allosteric Effect. CCS Chem., 2020, 2, 2223–2232. 该论文的第一作者是高分子科学系博士生许妙苗,通讯作者为高分子科学系闫强研究员。




