搜索

作为细胞骨架的基本构筑基元,微管(protein microtubule)是由很多蛋白质自组装构成的一种管状纤维,其管壁蛋白质排列精确有序,且组装和解组装过程具有动态可逆性。然而,使用天然蛋白质对这一结构进行模拟是非常困难的。
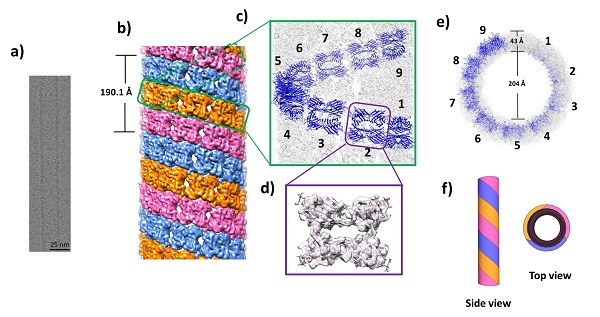
陈国颂-江明课题组利用该课题组前期发展的基于蛋白质和糖相互作用的蛋白质自组装新路线,以具有平面结构的天然蛋白质SBA为基本构筑基元,通过引入小分子配体,成功诱导了SBA自组装,形成了微米管。所得微管的管壁由单层蛋白质构成,其长度在微米级,而管的直径为26纳米,这和天然蛋白质微管的直径非常接近。他们和合作者使用高分辨冷冻透射电镜结合单粒子重构技术,对管壁蛋白质的排列进行解析,并利用计算机模拟给出了小分子在蛋白质之间的连接方式,最终获得了该纳米管的精细结构。结果表明,蛋白质SBA首先通过小分子所参与的糖-蛋白相互作用和小分子配体的π-π相互作用的介导,形成单链,该单链缠绕形成具有三螺旋结构的蛋白质微米管。每个螺旋的重复单元为9个蛋白质,螺距为19 纳米(如图)。同时,该微米管的形成和解离具有良好的动态特性。
该工作是和中科院化学与生物学交叉中心刘聪研究员合作完成,并得到了德国赫姆霍兹柏林研究所、清华大学等单位科研人员的大力协助和支持。详见原文:Guang Yang, Xiang Zhang, Zdravko Kochovski, Yufei Zhang, Bin Dai, Fuji Sakai, Lin Jiang, Yan Lu, Matthias Ballauff, Xueming Li, Cong Liu*, Guosong Chen*, Ming Jiang, “Precise and Reversible Protein-Microtubule-Like Structure with Helicity Driven by Dual Supramolecular Interactions”, J. Am. Chem. Soc., DOI: 10.1021/jacs.5b11733.