搜索

细胞与细胞外基质(ECM)的黏附对细胞的生理和病理过程至关重要,揭示仿ECM的生物材料表面的细胞黏附规律、尤其是相关调控细胞行为的nanocue,对于组织工程、再生医学和肿瘤靶向等均有重要的基础意义,也是指导面向生物医学和生物技术应用的新型材料设计的关键之一。
复旦大学丁建东课题组发展了独特的微纳米图案化技术,由此探究了细胞的临界黏附面积(图1),并考察了临界面积与固定在材料表面的配体的纳米间距之间的关系,进一步推测了在非图案化的自由表面上配体的最小有效纳米间距。

图1 本文探究的基本科学问题和关键术语的示意图:(a)通过一系列微米岛尺寸和配体纳米间距可调的微纳米及微米图案来控制细胞的黏附;(b)细胞在具有抗特异性黏附背景的微纳米图案表面的临界黏附面积示意图。
不同于单独的微米图案或纳米图案,丁建东课题组制备的微纳米图案可以同时调控微米岛的尺寸和纳米点之间的间距。首先运用嵌段共聚物胶束自组装纳米刻蚀技术获得纳米金点的阵列,之后结合微米光刻技术和氢氟酸(HF)刻蚀技术,得到玻片表面的金微纳米图案,然后通过硅烷化处理得到抗特异性黏附的背景,最后键接精氨酸-甘氨酸-天冬氨酸(RGD)多肽,制备出一系列具有细胞黏附反差的RGD微纳米图案(图2、图3)。

图2 微纳米图案的制备流程示意图。

图3 微纳米图案化材料表面形貌表征结果:场发射扫描电子显微镜对一系列微纳米岛内部金纳米阵列(a)和微米岛边缘(b)的表征;(c)典型的金纳米阵列的原子力显微镜表征结果。
RGD是ECM中一种可与细胞膜上的受体“整合素(Integrin)”相结合的配体,RGD的微纳米阵列可以调节细胞膜上整合素的空间分布,从而调控细胞的特异性黏附和相关的细胞行为。丁建东课题组利用此技术探究了人间充质干细胞(hMSC)在一系列RGD纳米间距(30 - 126 nm)和微米岛尺寸(10 - 80 μm)的微纳米黏附岛上的黏附数量(细胞个数从0到数个),发现在微纳米图案上存在细胞临界黏附面积,并且临界黏附面积随RGD纳米间距的增大而变大(图4)。
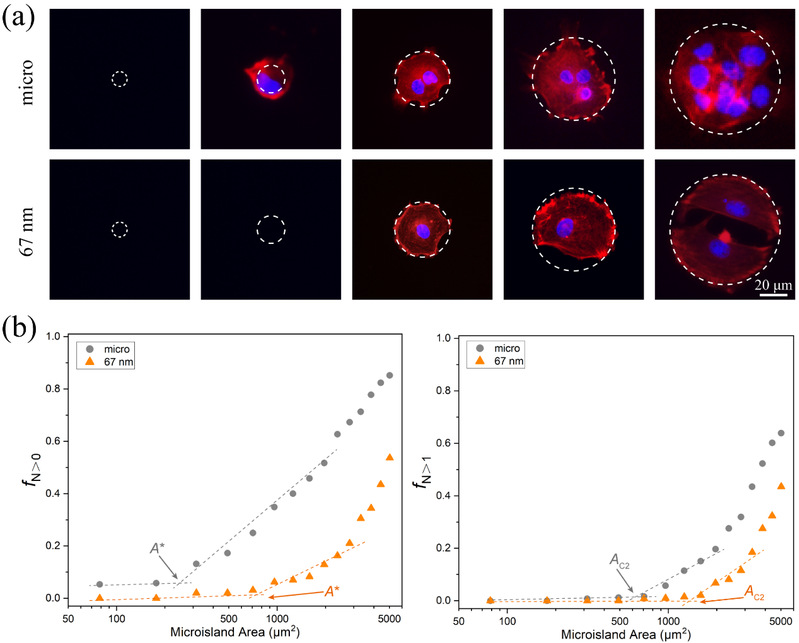
图4 (a)细胞的数量与微米和微纳米岛尺寸之间的关系;(b)随着微米岛尺寸的增加,通过实验结果来确定微纳米图案上细胞临界粘附面积的实验方法。
该基础研究的意义不限于针对图案化表面的细胞行为。人们早就认为,在非图案化自由表面上RGD配体的最小有效纳米间距并不是0,但是尚无任何研究可以确认这个数值,因为直接在非图案化表面或者单纯的微米/纳米图案化表面难以开展相关研究。复旦大学丁建东课题组借助其独到的微纳米杂合图案以及对临界细胞黏附面积的考察,通过对一系列RGD纳米间距计算出的细胞临界黏附面积进行渐进分析,首次获得了这个数值。第一临界黏附面积A*(细胞在黏附岛上从无到有)和第二临界黏附面积AC2(随黏附岛面积的增大细胞在黏附岛上从一个变为两个)的计算可以得到几乎一致的配体最小有效纳米间距,约为19 nm(图5)。
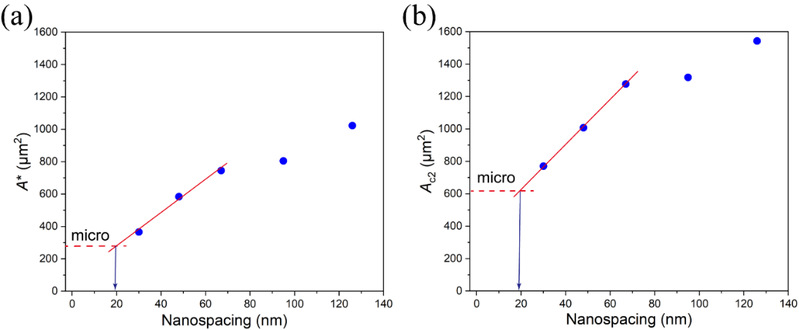
图5 细胞临界黏附面积与一系列微纳米图案的关系以及无图案自由表面上RGD最小有效纳米间距的渐近分析。
作者基于微纳米图案的特性,利用实验结果又进一步计算了整合素与细胞配体结合的临界数量(N*),结果表明N*随着RGD纳米间距的增大呈减小的趋势(图6),而非常数。
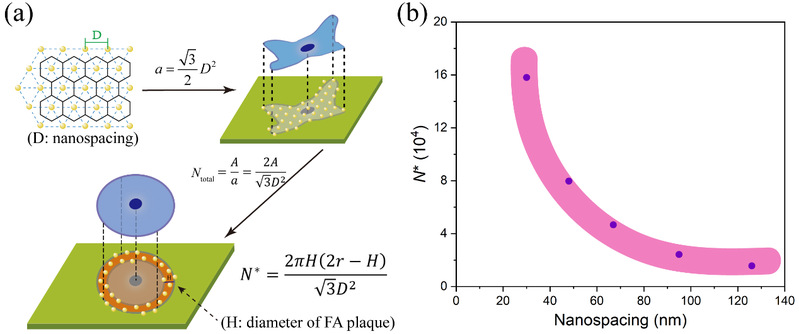
图6 (a)整合素与细胞配体结合的临界数量(N*)的推导过程示意图;(b)根据实验结果,得到的N*与纳米间距的曲线。
作者进一步借助统计物理处理有限元胞效应的理论处理方法,提出、并推导出了细胞在材料表面的“背景黏附”(background adhesion),它与特异性细胞黏附共同提供了细胞在材料表面的黏附力,并且细胞在临界黏附面积下对应的总黏附力是一个守恒量(图7)。丁建东课题组结合非特异性背景黏附和特异性细胞黏附,对细胞的临界受配体结合量提出了统一的解释。
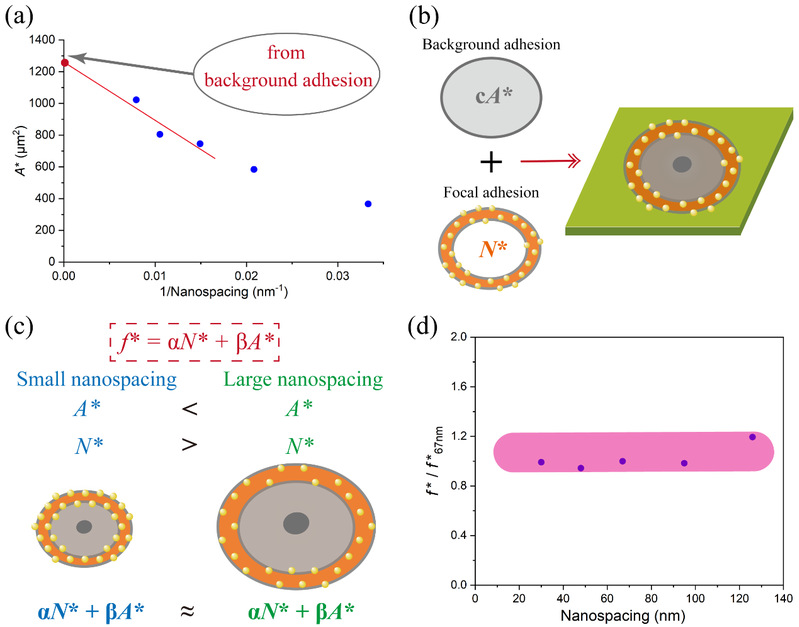
图7 细胞的非特异性背景黏附的推导和示意图,以及临界受配体结合量的最终计算推导结果。
最终,将该文工作结合其前期研究和其他科学家的相关研究,作者对细胞的最小有效配体纳米间距在生物大分子和细胞骨架网络的层面上作出了解释,并首次总结了不同尺度RGD纳米间距与细胞黏附的关系(图8)。丁建东课题组的基础理论研究为微米尺度和纳米尺度的细胞-材料之间的相互作用提供了更为全面的认识。
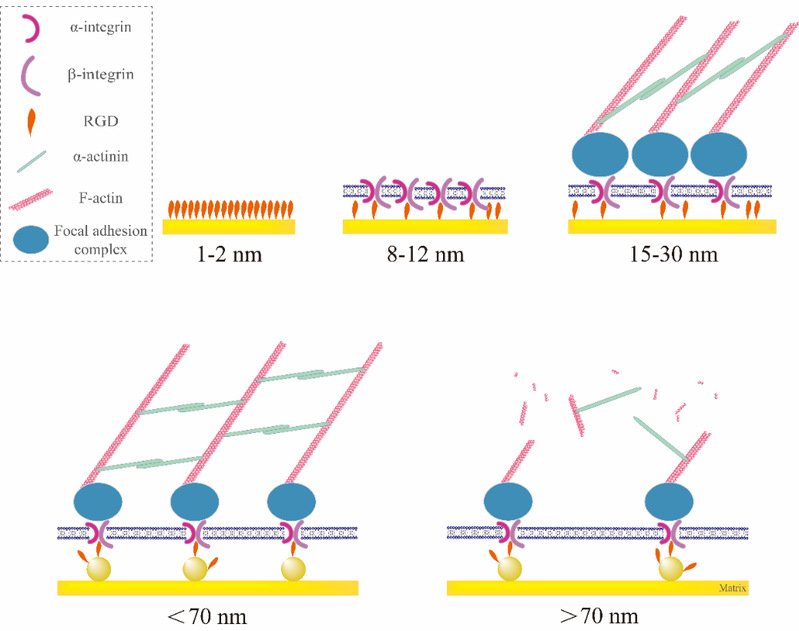
图8 不同尺度的RGD纳米间距调控细胞黏附的原理示意图。上行:即使在纯金表面密集接枝RGD多肽,由于RGD多肽自身尺寸的空间位阻会使得最近的2个RGD之间有1 - 2 nm的间距。Integrin与RGD一对一结合之后,由于整合素蛋白质的尺寸导致最近的2个有效结合的RGD之间有8 - 12 nm的间距。Integrin在细胞膜内侧连接的黏着斑复合物(focal adhesion complex)又有着一定的尺寸,最终导致有效的最近的2个RGD之间的间距约为15 - 30 nm,该文的推导结果(19 nm)恰好在这个范围内。下行:当RGD纳米间距小于70 nm时,细胞可以形成完整而有力的细胞骨架结够,在宏观上体现为细胞的黏附情况良好。当RGD纳米间距大于70 nm时,由于肌动蛋白的长度所限,细胞内部无法形成稳定的细胞骨架结构,从而体现为细胞黏附情况显著变差。
以上相关成果发表在Nano Research上。Shuang Zheng, Qiong Liu, Junhao He, Xinlei Wang, Kai Ye, Xuan Wang, Ce Yan, Peng Liu, Jiandong Ding*, Critical adhesion areas of cells on micro-nanopatterns, Nano Research (2021), doi.org/10.1007/s12274-021-3711-6。论文的第一作者是复旦大学高分子科学系、聚合物分子工程国家重点实验室博士生郑爽,通讯作者为该国重主任丁建东教授。




